生命科学研究中心/太阳成集团tyc7111cc杨崇林实验室
发表溶酶体稳态调控的最新研究成果
2019年6月24日,细胞生物学著名期刊The Journal of Cell Biology以Article形式在线发表了太阳成集团tyc7111cc生命科学中心/太阳成集团tyc7111cc杨崇林实验室的研究论文“氨基酸转运蛋白SLC-36.1协同磷脂酰肌醇-3磷酸激酶调控吞噬溶酶体的再形成”(The amino acid transporter SLC-36.1 cooperates with PtdIns3P 5-kinase to control phagocytic lysosome reformation)。

溶酶体是细胞中重要的细胞器,具有生物降解、代谢稳态维持、分泌、营养信号感知及传递等功能。溶酶体功能失调会导致严重的人类疾病,如溶酶体贮积症和神经退行性疾病等。来自内吞作用、吞噬作用和自噬的货物都会被运送到溶酶体,随后这些货物会在内吞溶酶体、吞噬溶酶体和自噬溶酶体中的酸性水解酶的作用下被降解。然而,我们对货物被降解之后,溶酶体从内吞溶酶体、吞噬溶酶体和自噬溶酶体上再形成的过程和调控机制却知之甚少。杨崇林实验室以秀丽线虫为模式、以吞噬溶酶体为突破口,经过多年探索,揭示了吞噬溶酶体再形成的过程和调控机制。
秀丽线虫是研究细胞凋亡的理想实验材料,在微分干涉显微镜下,线虫胚胎细胞发生凋亡后呈现出特殊的纽扣状突起形态。杨崇林实验室通过正向遗传学筛选,获得了多个凋亡细胞呈凹坑状的突变体,经克隆发现是由于slc-36.1基因功能缺失突变导致。SLC-36.1蛋白在人类中的同源物是中性氨基酸转运蛋白SLC-36A1。SLC-36.1定位在细胞质膜和溶酶体膜上,而且它的氨基酸转运活性对于其功能是必须的。研究者用绿色荧光蛋白标记溶酶体膜蛋白LAAT-1,用红色荧光蛋白标记溶酶体基质蛋白NUC-1,在荧光显微镜追踪溶酶体在生理条件下的变化过程。在野生型线虫的胚胎中,随着吞噬溶酶体不断伸出丝状结构,并显示有新的溶酶体产生,而吞噬溶酶体的体积不断缩小并最终消失。但是,在slc-36.1突变体的胚胎中,吞噬溶酶体出丝的次数明显减少,并且吞噬溶酶体的体积在很长时间内都保持不变(下图)。因此,SLC-36.1对于溶酶体从吞噬溶酶体上再形成的过程是必需的。
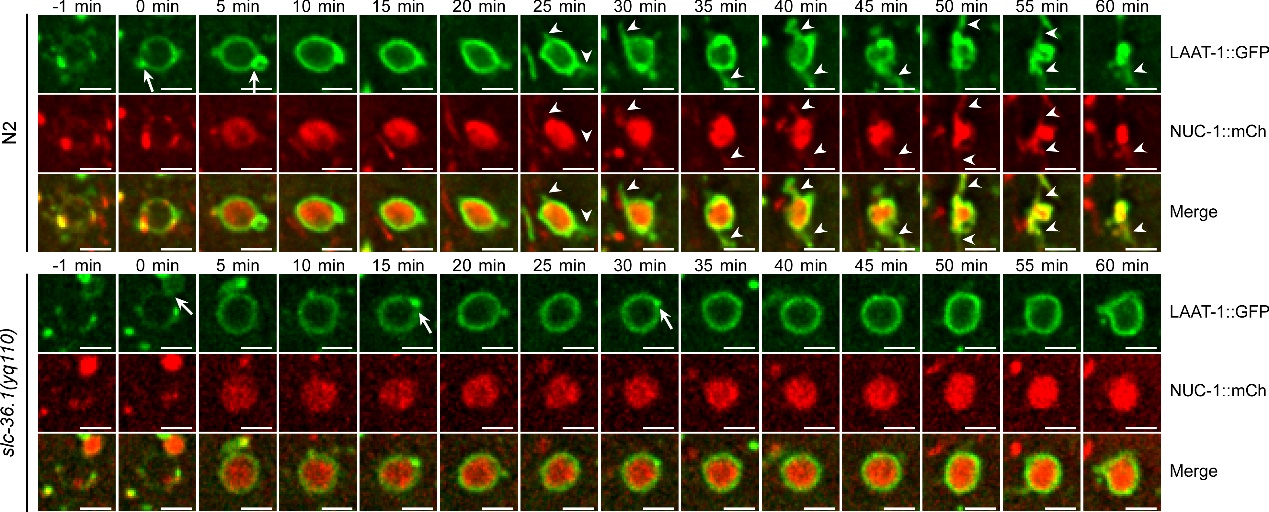
SLC-36.1为溶酶体从吞噬溶酶体上再形成所必需
该研究还发现PPK-3功能缺失同样会阻碍溶酶体从吞噬溶酶体上再形成。PPK-3是磷脂酰肌醇-3磷酸激酶,能够催化磷脂酰肌醇-3-磷酸继续磷酸化,生成磷脂酰肌醇-3,5-二磷酸,已知磷脂酰肌醇-3,5-二磷酸对于膜分裂起着重要作用。进一步的研究表明,SLC-36.1直接与PPK-3相互作用,形成复合体,协同作用发挥调控作用。研究还发现,在溶酶体从自噬溶酶体上再形成的过程中,SLC-36.1-PPK-3复合物也发挥了调控作用。
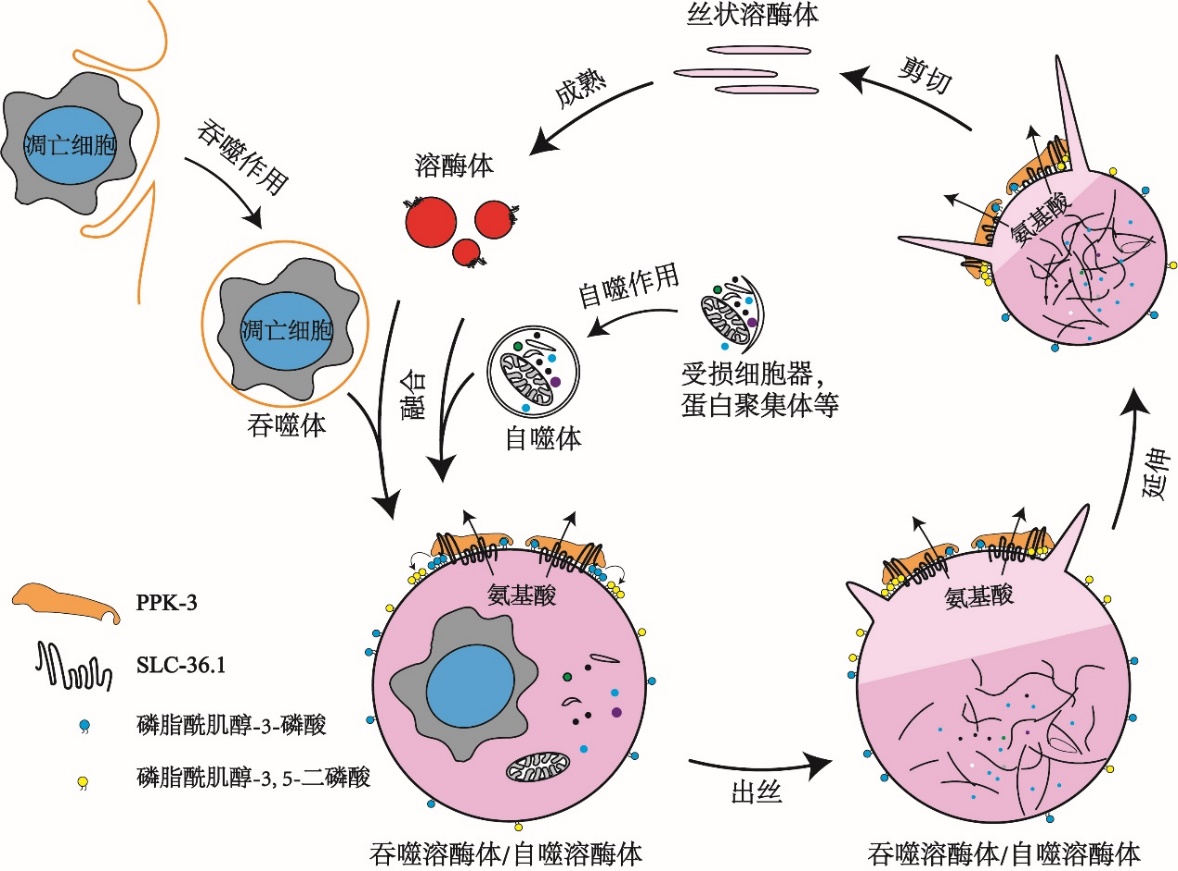
SLC-36.1-PPK-3复合物调控溶酶体再形成的模式图
本项研究阐明了SLC-36.1-PPK-3复合物在吞噬溶酶体或自噬溶酶体上溶酶体再形成的过程中起到了至关重要的调控作用。
太阳成集团tyc7111cc省部共建云南生物资源保护与利用国家重点实验室、生命科学中心以及太阳成集团tyc7111cc为本研究的第一单位,杨崇林实验室的甘启文博士为本文第一作者,杨崇林教授为通讯作者。该研究获国家自然基金委员会重点项目 (31730053) 和科技部重点研发计划(2017YFA0503403)的资助。


